[生]在教师引导下进行表格数据的分析,小组讨论解决上述两个问题。
[生1]同一元素逐级电离能逐渐增大。
[生2]因为随着电子的逐个失去,阳离子所带的正电荷数越来越大、半径越来越小,对核外电子的吸引能力越来越强,再要失去一个电子需克服的电性引力也越来越大,消耗的能量也越来越多。因此原子的逐级电离能越来越大。
[过渡] 在实际应用中,若不特殊说明,一般指的是第一电离能,下面我们共同来探究同周期主族元素第一电离能的变化规律。
[投影](2)同周期主族元素第一电离能变化规律的探究
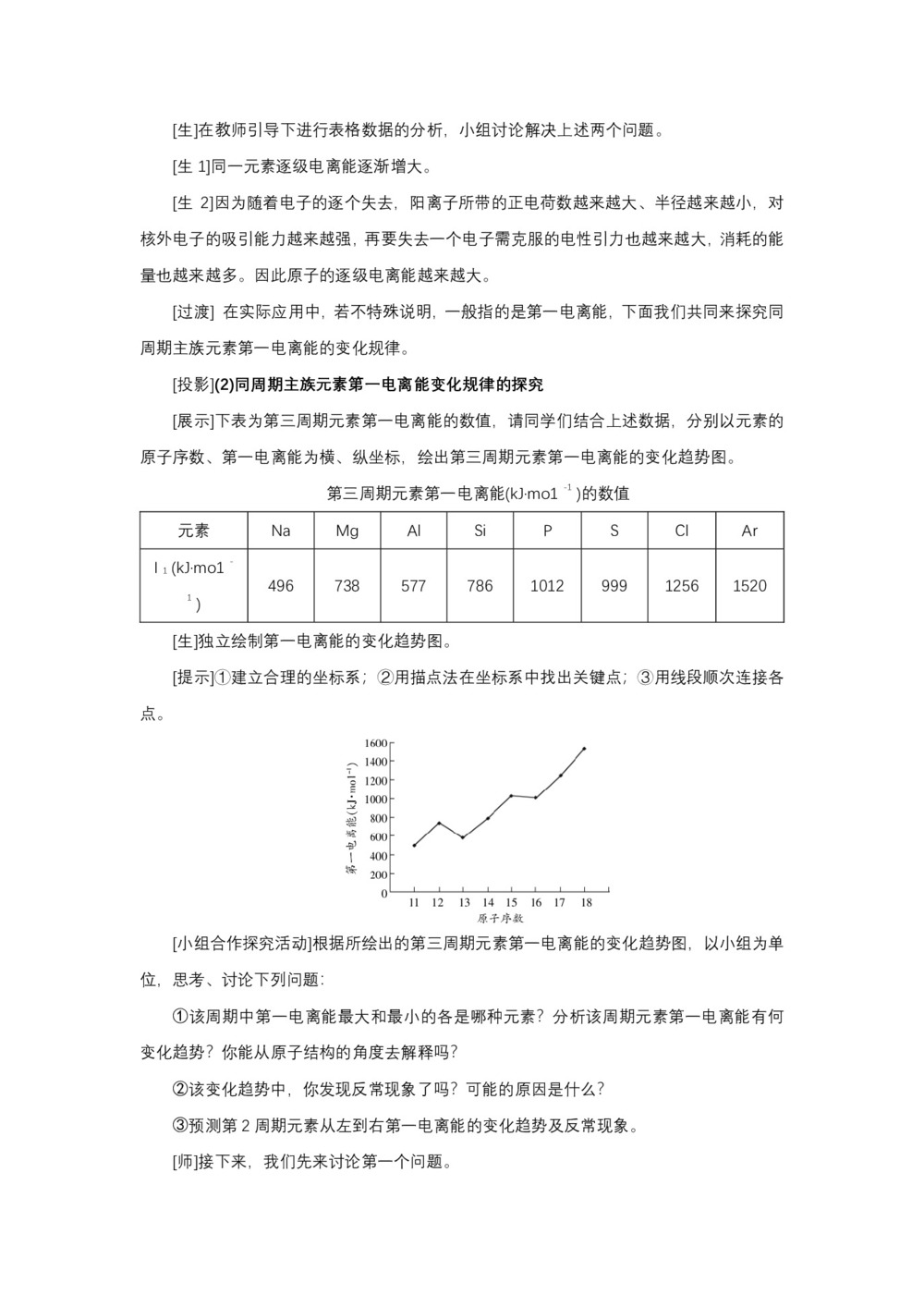
[展示]下表为第三周期元素第一电离能的数值,请同学们结合上述数据,分别以元素的原子序数、第一电离能为横、纵坐标,绘出第三周期元素第一电离能的变化趋势图。
第三周期元素第一电离能(kJ·mo1 -1 )的数值
元素 Na Mg Al Si P S Cl Ar I 1 (kJ·mo1 -1 ) 496 738 577 786 1012 999 1256 1520 [生]独立绘制第一电离能的变化趋势图。
[提示]①建立合理的坐标系;②用描点法在坐标系中找出关键点;③用线段顺次连接各点。
[小组合作探究活动]根据所绘出的第三周期元素第一电离能的变化趋势图,以小组为单位,思考、讨论下列问题:
①该周期中第一电离能最大和最小的各是哪种元素?分析该周期元素第一电离能有何变化趋势?你能从原子结构的角度去解释吗?
②该变化趋势中,你发现反常现象了吗?可能的原因是什么?
③预测第2周期元素从左到右第一电离能的变化趋势及反常现象。
[师]接下来,我们先来讨论第一个问题。
[提示]原子结构主要指的是核外电子排布(尤其是最外层电子排布)、核电荷数、原子
-
相关教案下载
- 12018-2019学年人教版选修3第1章第2节原子结构与元素的性质教案
- 22017-2018学年人教版选修三 1.2原子结构与元素的性质 学案
- 32018-2019学年高中化学人教版选修3教案:1.2原子结构与元素的性质(第2课时) Word版含解析
- 42018-2019学年人教版选修3第1章第2节原子结构与元素的性质教案1
- 52018-2019学年人教版选修3第1章第2节原子结构与元素的性质第3课时教案
- 62018-2019学年高中化学人教版选修3教案:1.2原子结构与元素的性质(第3课时) Word版含解析
- 72018-2019学年人教版选修3第1章第2节原子结构与元素的性质第2课时学案
- 82018-2019学年人教版选修3 第一章原子结构与性质--原子结构模型 教案
- 92018-2019学年高中化学人教版选修3教案:1.2原子结构与元素的性质(第1课时) Word版含解析